衰老对骨骼肌肉疾病的影响有哪些?
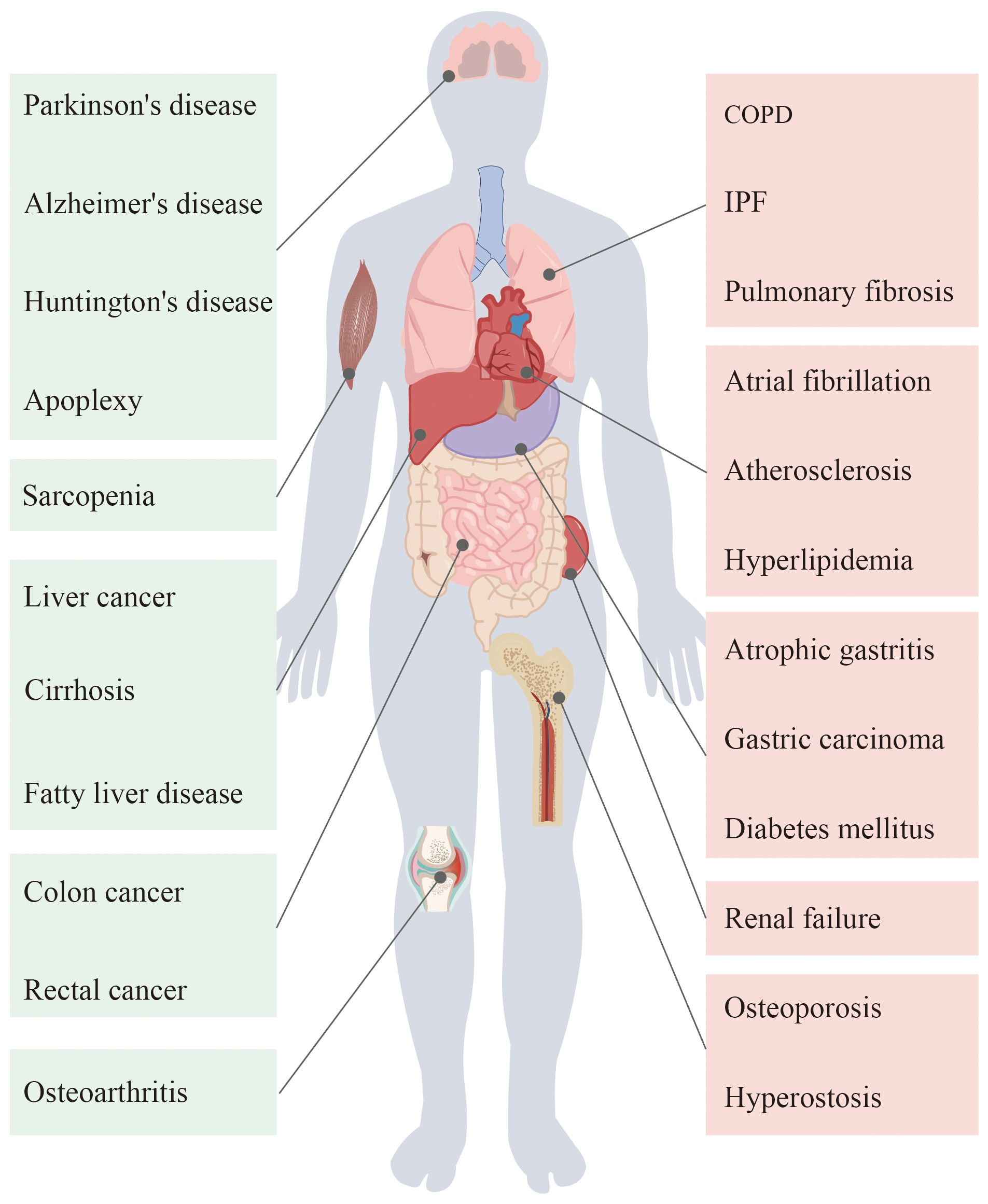 图1.衰老在人体器官中会出现不同程度的病理变化,从而引起多种疾病。
图1.衰老在人体器官中会出现不同程度的病理变化,从而引起多种疾病。

一、衰老机制
衰老对人体的影响是全面而复杂的,会影响到人体的各个系统,导致功能退化,甚至发生疾病。随着衰老研究的深入,衰老的机理逐渐浮出水面。衰老的机制错综复杂,相互关联,影响着整个身体的状态(图2)。
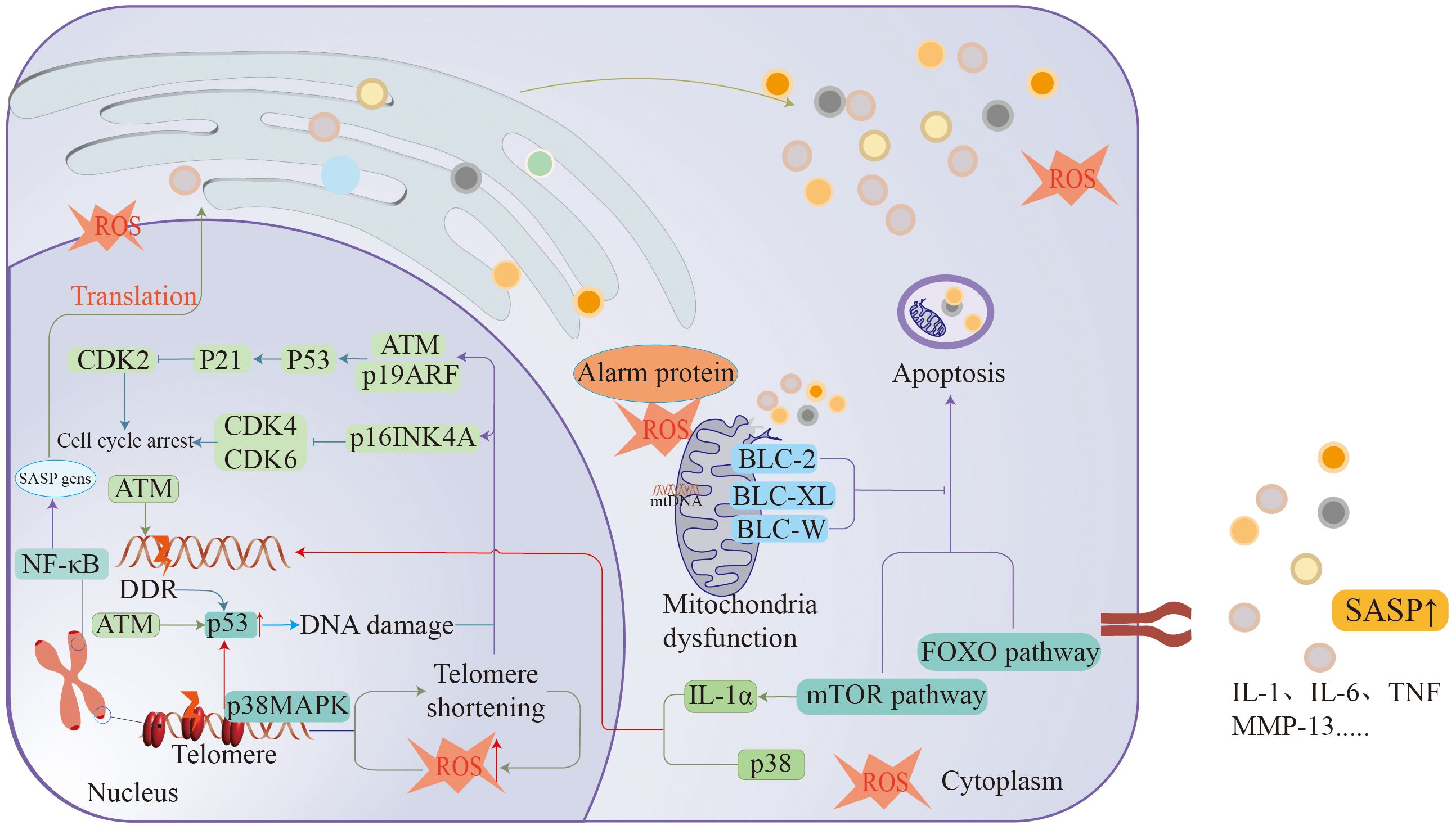
图2.衰老与许多机制有关,如DDR、细胞衰老、巨噬细胞功能障碍、端粒丢失等,所有这些都导致细胞分裂周期停滞,从而促进衰老的形成。
1.细胞衰老
细胞衰老是由Hayflick和Moorhead于1961年首次提出的概念,指的是细胞不可逆的分裂停滞状态,随时间积累并导致机体功能障碍。这一过程涉及端粒缩短、致癌基因激活及线粒体功能损伤等因素。虽然细胞停止生长,它们在伤口恢复和限制癌前细胞复制中发挥积极作用,显示出抗癌潜力,并在多种与年龄相关的疾病中扮演关键角色。
细胞衰老是一个复杂而动态的过程,由多种分子途径如DNA损伤反应(DDR)、INK4/ARF基因座激活、p53/p21路径等引发。这些路径通过调节细胞周期和染色质重组,促进细胞进入稳定的生长停滞状态。特别是,DDR在细胞受损时积聚在DNA损伤处,通过激酶如ATM和ATR推动细胞进入衰老状态。
此外,细胞衰老还与细胞环境交互作用,通过分泌多种细胞因子形成所谓的SASP(衰老细胞分泌表型),这在不同组织的衰老过程中表现各异。SASP含多种炎症因子,通过多种分泌途径调节细胞和组织的衰老,其蛋白质组成和功能在近年研究中得到了更深入的了解。总的来说,细胞衰老不仅是生物体抗击癌症的一种机制,也在多个层面上调节组织的生物学功能。
2.端粒磨损
端粒缩短是细胞衰老的重要机制之一。随着细胞的不断分裂,端粒逐渐缩短,这不仅导致DNA的异常变化,还可能引起衰老、细胞凋亡和分化障碍,进而触发各种疾病。此外,端粒在受到氧化应激如ROS的影响时,会加速某些高增殖组织如骨骼肌和心肌的衰老,增加患病风险。端粒缩短还与衰老相关炎症紧密相关,这种炎症反应可加剧端粒损伤,形成恶性循环。因此,维持线粒体活性并抑制ROS增加是防治衰老相关疾病的关键策略。
3.炎症
炎症是衰老过程中的一个关键因素,常见于老化的组织细胞中,引起免疫反应和疾病发展。慢性炎症被视为衰老的标志,与衰老相关的分泌表型(SASP)诱导细胞衰老,进而影响免疫细胞,形成恶性循环,加速衰老进程。在细胞层面,线粒体功能障碍、DNA损伤和氧化应激能引发慢性炎症,衰老细胞释放的SASP包含关键的炎症介质如IL-1b和IL-6,加剧炎症。氧化应激通过破坏细胞内生物因子并增加炎症介质的分泌,进一步激发全身炎症反应,加速细胞衰老。此外,受损DNA释放到细胞质中也可直接触发炎症反应,促进衰老。
4.自噬的破坏
自噬是一个关键的代谢过程,它通过分解异常的大分子和细胞器来维持细胞的稳定。随着年龄的增长,自噬活性自然下降,同时,自噬囊泡的积累导致活性进一步减弱。这一过程主要受到胰岛素/IGF-1信号通路的调控,以及与mTOR和FOXO的相互作用。年龄的增加会影响这些调控途径,进而影响自噬活性。特别是在老年人的肌肉组织中,mTOR活性的增加和FOXO活性的失调可能导致肌肉疾病和软骨退化。这些变化凸显了自噬在衰老和相关疾病中的重要作用。
5.线粒体功能障碍
线粒体在细胞的正常生理和衰老过程中扮演关键角色。随着年龄增长,线粒体DNA(mtDNA)突变积累,导致氧化磷酸化失调和活性氧(ROS)增多,从而引发细胞衰老。实验表明,mtDNA突变和缺失的累积与多种衰老表现如肌肉减少、骨质疏松和生育能力下降等相关。此外,老年人褪黑激素分泌减少,促使mtDNA释放,激活cGAS/STING/IRF3信号通路,并产生炎性细胞因子,加速细胞衰老。
线粒体功能障碍也与慢性炎症及免疫反应的发展密切相关。线粒体衍生分子如mtDNA、ATP等可通过不同途径诱导炎症。特别是mtDNA,其为强效的免疫激活剂,能通过TLR9等模式识别受体(PRR)激发炎症反应。此外,年老的供体器官在移植后可能诱发受体细胞衰老,降低器官存活率,而针对线粒体的药物干预或senolytics治疗显示出改善移植器官存活和降低炎症的潜力。因此,靶向线粒体的治疗策略可能对抗衰老和相关疾病具有重要意义。
6.蛋白质稳态
人体的许多生理功能依赖于蛋白质,其损伤和失活可能引发多种疾病。神经系统疾病通常与蛋白质损伤相关。细胞为防止蛋白质错误折叠,会产生伴侣蛋白。在蛋白质结构稳态发生变化时,自噬和未折叠蛋白反应(UPR)协同作用以清除异常蛋白。转录因子ATF3和ATF4在调节UPR中起关键作用,它们的异常表达可能导致蛋白泛素化失败,加速衰老及相关疾病的发生。此外,泛素样分子SUMO可增强蛋白质稳定性,其基因沉默可能缩短生命。胰岛素样生长因子-1 (IGF-1)通过调节自噬-溶酶体系统来抑制异常蛋白的降解,从而抑制衰老,但在肌肉系统中适量的IGF-1是必需的,以维持肌肉力量。
7.基因组不稳定性
基因组受多种因素影响,易受损害。为应对,生物体发展了复杂的DNA损伤修复机制。这些机制能阻止损伤DNA复制,避免遗传信息传递给后代。然而,随着年龄增长,这些机制效率下降,导致基因损伤累积,进而引发衰老。研究表明,基因突变与衰老正相关,而提高基因组稳定性则可延缓衰老。例如,SIRT6基因在小鼠中的过表达已被证实可以增强基因组稳定性,从而延长寿命。

8.表观遗传变化
表观遗传变化,包括DNA甲基化、异常组蛋白修饰和染色质重塑,是促进老龄化的关键因素。这些变化导致了衰老相关疾病的发生,如癌症、代谢性疾病和神经系统疾病等。DNA甲基化是通过DNA与蛋白质结合抑制基因表达,是一种稳定的遗传修饰形式。研究显示,衰老细胞的DNA甲基化水平低于其他细胞,且随着衰老逐渐降低。学者如Steve Horvath和Levine通过研究提出了表观遗传时钟和DNA表型年龄理论,指出DNA甲基化水平与衰老密切相关。组蛋白修饰,特别是甲基化和乙酰化的变化,同样在衰老过程中有明显变化,影响转录功能的调控。例如,Hutchinson-Gilford综合征和Werner综合征患者中染色质异常明显,相关组蛋白甲基转移酶水平显著降低。此外,降低组蛋白乙酰转移酶活性已被证实能延长早衰小鼠的寿命。这些研究不仅揭示了表观遗传学在衰老过程中的作用,也为未来抗衰老策略提供了可能的生物标记。
9.营养感知下降
营养感知是人类细胞识别葡萄糖等营养物质的能力。人类细胞通过特定的信号途径,如胰岛素/IGF-1、mTOR和AMPK,识别并调节营养物质如葡萄糖的吸收和分配。这些途径不仅调节细胞状态,还通过反馈回路影响体内的代谢过程,包括蛋白质与核苷酸的合成。随着年龄的增长,这些网络促进合成代谢进程和衰老。此外,人体微生物群也参与营养感知,特别是肠脑轴表明肠道微生物与大脑间的相互作用。这些微生物在代谢和免疫应答中起着重要角色,并可能通过促进炎症加速衰老及相关疾病的发展。研究显示,补充特定的肠道微生物代谢物能在一定程度上改善衰老大脑中小胶质细胞的功能。
10.干细胞衰竭
干细胞因其在再生和分化上的潜力,在细胞更新和受损组织修复中扮演关键角色。随着年龄增长,干细胞的自噬活性减少,这会导致它们的分化和增殖能力下降。自噬是维持干细胞活性和区分能力的重要机制,尤其是骨髓间充质干细胞的自噬活动,对抑制干细胞老化尤为有效。此外,衰老还会触发一系列不对称的细胞分裂和分化过程,这可能导致干细胞耗竭或增殖分化异常。相关研究显示,衰老对T细胞的分裂和分化也有显著影响,可能导致T细胞过早衰老和功能受损。
11.细胞间通讯的变化
人体生理活动依赖于复杂的信息传递系统,通过细胞间的通讯网络连接各器官、组织和细胞,维持生命活动的整体性。细胞间的信息传递主要通过信号因子的释放等方式,影响周围细胞。特别是衰老细胞,它们通过分泌信号、细胞融合等多种方式与邻近细胞交流,促进炎症和衰老的扩散,影响人体健康。
二、衰老在肌肉骨骼系统疾病中的作用
肌肉骨骼系统疾病在老年人中广泛发生,全世界约有17.1亿人患有肌肉骨骼疾病。肌肉骨骼系统疾病对人们的生活质量有很大的影响,严重限制了患者的行动能力和劳动力从事社会活动的能力。随着人口老龄化,未来疾病的数量将继续增加(114)(图3)。
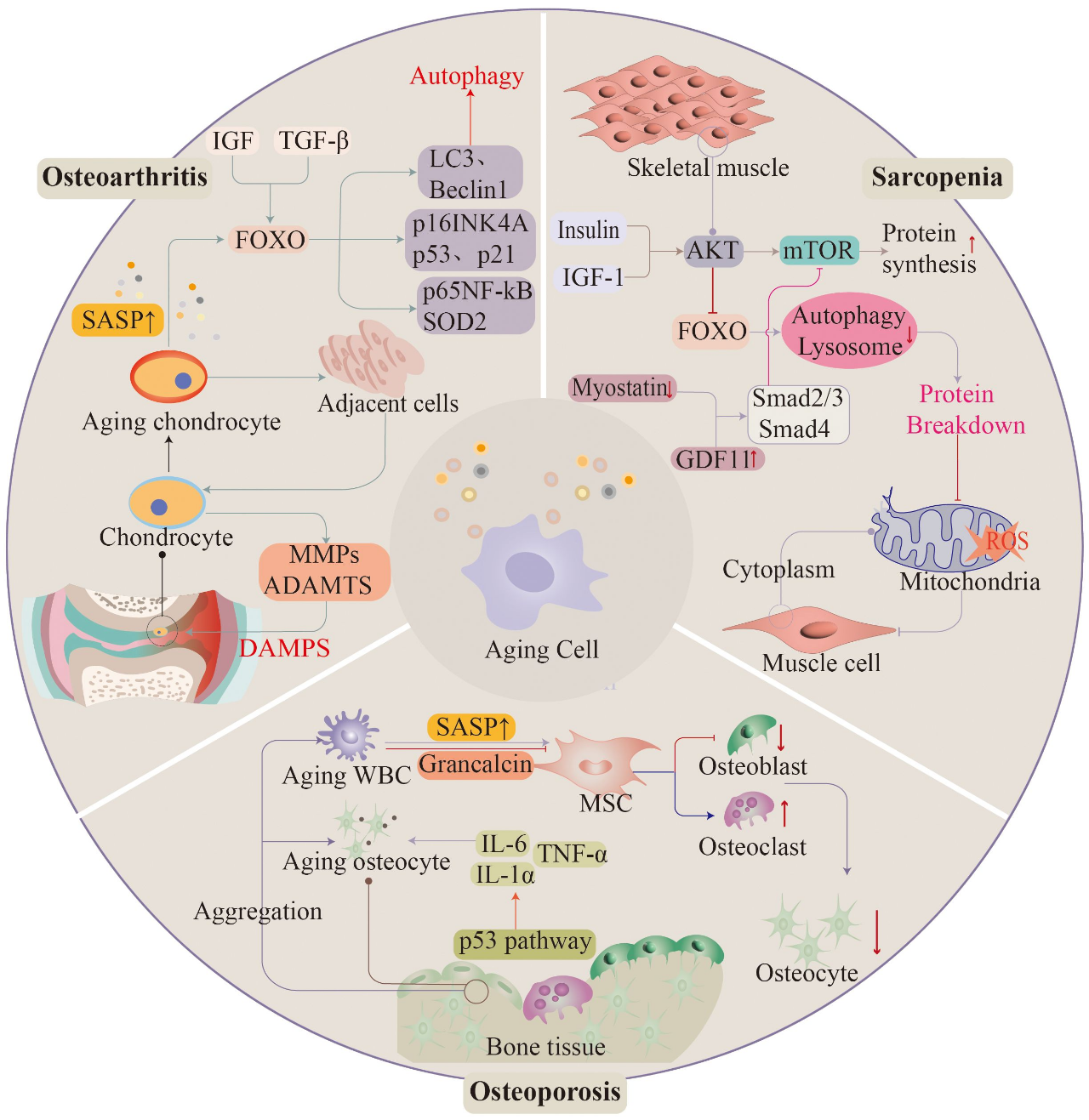
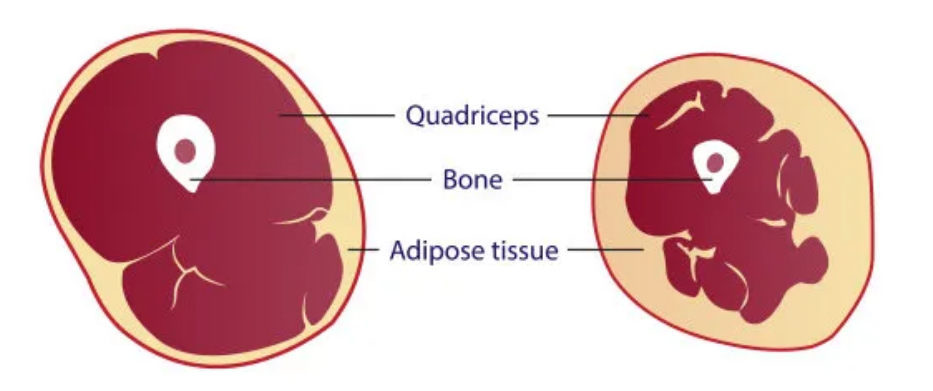
图3.随着年龄的增长,肌肉骨骼系统经常出现明显的功能退化。骨关节炎、骨质疏松症和肌肉减少症与衰老有关。组织细胞的老化促进了这些疾病的发展。
1.衰老和骨关节炎
骨关节炎(Osteoarthritis, OA)是一种常见的慢性退行性关节病,主要影响老年人群。该病症表现为软骨退化和骨赘形成,导致关节疼痛和活动受限。骨关节炎的发生与多种因素有关,包括年龄、肥胖、性别和遗传等。随着年龄的增长,关节软骨的损伤几乎不可避免,这反过来影响骨骼和关节的功能。
研究表明,细胞衰老是骨关节炎发展的一个重要因素。关节软骨中的细胞衰老不仅与年龄相关,还可能由机械损伤引起。软骨细胞的老化可以导致关节内其他细胞的功能改变,这种现象被称为“SASP”(细胞衰老相关的分泌表型)。例如,IL-6和IL-1a等细胞因子的异常表达与软骨细胞损伤和衰老相关,这些因子的水平升高可能加速骨关节炎的发展。
目前,治疗骨关节炎的方法包括修复关节软骨或向关节腔内注射治疗剂,如干细胞。了解细胞衰老与骨关节炎的关系对于开发新的治疗方法具有重要意义。此外,研究衰老和SASP机制也有助于发现延缓系统功能丧失的共同因素,这不仅可以延长寿命,还可以提高生活质量。
随着相关研究的深入,未来可能会发现更多影响骨关节炎进程的年龄相关因素,为治疗提供新的策略。
2.衰老与骨质疏松(OP)
骨质疏松症(OP)是一种与年龄紧密相关的疾病,其特征为骨质流失和显微结构的变化。研究显示,细胞衰老过程中,大量的衰老细胞相关分泌物(SASP)的释放会破坏骨稳态平衡,从而诱发OP。衰老细胞的治疗能显著改善骨质流失情况。骨细胞,占所有骨相关细胞的90%,在骨的生理功能中扮演重要角色。随着年龄的增长,骨细胞和骨髓细胞的衰老加剧,导致SASP因子的表达增多,进而影响骨质的代谢和健康。此外,雌激素水平的变化也对骨细胞的代谢产生重要影响,绝经后雌激素水平的下降会加速骨质流失。研究还发现,使用抗衰老药物能有效改善衰老小鼠的骨骼微结构和力量,减少破骨细胞数量,增加成骨细胞数量。这些发现为OP的防治提供了新的视角和策略。
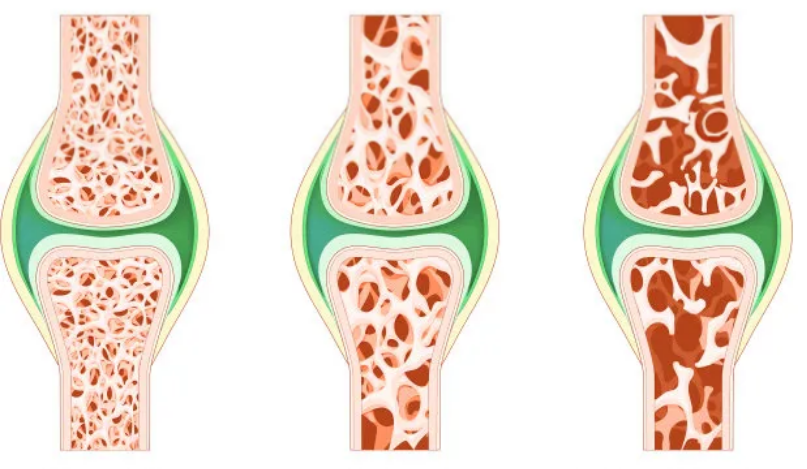
3.衰老和肌肉减少症
肌肉减少症是一种随着年龄增长而导致肌肉力量和质量丧失的疾病。这种病症不仅增加了骨折和身体虚弱的风险,而且是衰老的一种自然标志。细胞老化,特别是由DNA损伤引起的,是肌肉减少症的一个重要原因,这种现象在老年小鼠中尤为明显,其骨骼肌细胞中的特定炎症因子(如Igfbp2、MMP13和Pai1)表达水平升高。
研究显示,衰老过程中的炎症反应增加和细胞功能的减退导致肌肉量的减少。例如,OPA1蛋白水平的下降会直接影响肌肉细胞的代谢,进而导致肌肉损失。此外,炎症因子如IL-6的过度表达会显著导致肌肉萎缩。IL-6不仅减少肌肉合成,还可能直接介导肌肉分解。
最近的研究还发现,骨骼肌除了是运动的执行者,还具有免疫调节的功能,能够通过释放细胞因子如IL-6来调节免疫系统。对于肌肉减少症的治疗,研究表明,IL-6抗体的使用可以有效改善肌肉状况。同时,IL-15和其他因子的调节也显示出在促进肌肉恢复方面的潜力。
随着年龄的增长,体内的AMPK活性降低,这也是导致肌肉损失的一个因素。
三、肌肉骨骼系统疾病的靶向衰老治疗

衰老是自然现象,随着年龄增长,人体疾病的发病率亦随之上升。目前,科学研究主要通过抑制细胞衰老来预防和治疗相关疾病。抑制衰老细胞的生长已被证实是对抗多种与年龄相关疾病的有效方法。
在抗衰老策略中,Senolytics和Senomorphics是两种主要方法。Senolytics通过促进衰老细胞的凋亡来干预衰老细胞内的信号调节途径;而Senomorphics则通过降低衰老细胞分泌的SASP成分来减少对正常组织的损伤,从而抑制衰老。
在实际治疗中,抗衰老治疗的时机至关重要。例如,Navitoclax能在炎症的初期阶段通过抑制特定蛋白来清除衰老细胞,促进组织再生。其他药物如槲皮素和达沙替尼则通过刺激相关靶点来消除衰老细胞,有效缓解骨关节炎的进展。此外,UBX0101等抗衰老剂通过特定机制清除关节内的衰老细胞,减缓骨关节炎的发展。
在动物实验和临床试验中,一些药物已显示出对骨质疏松症等疾病的良好治疗效果。此外,针对SASP中的关键因素,如MMP13的抑制,也被证明可以减少与骨关节炎相关的病变。
总体而言,通过抑制和管理衰老细胞,我们能够更有效地处理许多与年龄相关的健康问题,为延缓衰老和提高生活质量提供了新的策略和希望。
衰老是一个自然且不可避免的过程,它影响人体的所有系统和器官。衰老机制的复杂性在于多种因素的相互作用,这些研究对于提升老年人的生活质量具有极大的意义。特别是在肌肉骨骼系统中,相关疾病广泛影响生活质量,严重时甚至导致活动能力丧失,对个体的心理和生理健康造成深远影响。随着人口老龄化,这些疾病的患者数量预计将持续增加,给公共医疗保健系统带来更大的压力。
目前,关于衰老的研究多集中在动物和细胞层面,尚需深入探索各种机制之间的相互作用以及它们如何共同促进衰老过程。尤其是在关节炎(OA)的治疗上,由于受损软骨的难以恢复,早期干预显得尤为重要。未来,通过对衰老的早期干预,不仅可以延缓肌肉骨骼疾病的进展,还有助于减轻由老龄化引起的公共医疗压力,优化社会劳动力问题。
参考文献 1. López-Otín C, Blasco MA, Partridge L, Serrano M, Kroemer G. Hallmarks of aging: An expanding universe. Cell. (2023) 186:243–78. doi: 10.1016/j.cell.2022.11.001 PubMed Abstract | CrossRef Full Text | Google Scholar 2. Roberts S, Colombier P, Sowman A, Mennan C, Rölfing JH, Guicheux J, et al. Ageing in the musculoskeletal system. Acta orthopaedica. (2016) 87:15–25. doi: 10.1080/17453674.2016.1244750 PubMed Abstract | CrossRef Full Text | Google Scholar 3. Song S, Guo Y, Yang Y, Fu D. Advances in pathogenesis and therapeutic strategies for osteoporosis. Pharmacol Ther. (2022) 237:108168. doi: 10.1016/j.pharmthera.2022.108168 PubMed Abstract | CrossRef Full Text | Google Scholar 4. Nedergaard A, Henriksen K, Karsdal MA, Christiansen C. Musculoskeletal ageing and primary prevention. Best Pract Res Clin obstetrics gynaecology. (2013) 27:673–88. doi: 10.1016/j.bpobgyn.2013.06.001 CrossRef Full Text | Google Scholar 5. Martel-Pelletier J, Barr AJ, Cicuttini FM, Conaghan PG, Cooper C, Goldring MB, et al. Osteoarthritis. Nat Rev Dis Primers. (2016) 2:16072. doi: 10.1038/nrdp.2016.72 PubMed Abstract | CrossRef Full Text | Google Scholar 6. Cruz-Jentoft AJ, Baeyens JP, Bauer JM, Boirie Y, Cederholm T, Landi F, et al. Sarcopenia: European consensus on definition and diagnosis: Report of the European Working Group on Sarcopenia in Older People. Age Ageing. (2010) 39:412–23. doi: 10.1093/ageing/afq034 PubMed Abstract | CrossRef Full Text | Google Scholar 7. Hayflick L, Moorhead PS. The serial cultivation of human diploid cell strains. Exp Cell Res. (1961) 25:585–621. doi: 10.1016/0014-4827(61)90192-6 PubMed Abstract | CrossRef Full Text | Google Scholar 8. Di Micco R, Krizhanovsky V, Baker D, d'Adda di Fagagna F. Cellular senescence in ageing: from mechanisms to therapeutic opportunities. Nat Rev Mol Cell Biol. (2021) 22:75–95. doi: 10.1038/s41580-020-00314-w PubMed Abstract | CrossRef Full Text | Google Scholar 9. Salama R, Sadaie M, Hoare M, Narita M. Cellular senescence and its effector programs. Genes Dev. (2014) 28:99–114. doi: 10.1101/gad.235184.113 PubMed Abstract | CrossRef Full Text | Google Scholar 10. Jun JI, Lau LF. The matricellular protein CCN1 induces fibroblast senescence and restricts fibrosis in cutaneous wound healing. Nat Cell Biol. (2010) 12:676–85. doi: 10.1038/ncb2070 PubMed Abstract | CrossRef Full Text | Google Scholar 11. Demaria M, Ohtani N, Youssef SA, Rodier F, Toussaint W, Mitchell JR, et al. An essential role for senescent cells in optimal wound healing through secretion of PDGF-AA. Dev Cell. (2014) 31:722–33. doi: 10.1016/j.devcel.2014.11.012 PubMed Abstract | CrossRef Full Text | Google Scholar 12. Collado M, Serrano M. Senescence in tumours: evidence from mice and humans. Nat Rev Cancer. (2010) 10:51–7. doi: 10.1038/nrc2772 PubMed Abstract | CrossRef Full Text | Google Scholar 13. Yosef R, Pilpel N, Tokarsky-Amiel R, Biran A, Ovadya Y, Cohen S, et al. Directed elimination of senescent cells by inhibition of BCL-W and BCL-XL. Nat Commun. (2016) 7:11190. doi: 10.1038/ncomms11190 PubMed Abstract | CrossRef Full Text | Google Scholar 14. Herranz N, Gil J. Mechanisms and functions of cellular senescence. J Clin Invest. (2018) 128:1238–46. doi: 10.1172/JCI95148 PubMed Abstract | CrossRef Full Text | Google Scholar 15. Lowe SW, Cepero E, Evan G. Intrinsic tumour suppression. Nature. (2004) 432:307–15. doi: 10.1038/nature03098 PubMed Abstract | CrossRef Full Text | Google Scholar


